 Página anterior Página anterior |   Voltar ao início do trabalho Voltar ao início do trabalho | Página seguinte  |
Estas observações foram realizadas no Laboratório de Nutrição de Peixes de Clima Tropical/EPAGRI, localizado na cidade de Caçador (SC).
Para a realização deste estudo, foram utilizadas cepas de Chlorella minutissima recebidas da Universidade Federal de Santa Catarina-UFSC e conservadas em tubo de ensaio na geladeira, com densidade de 3.0 x 103 células/ml. O meio de cultivo enriquecido foi o de Myer’s 4N modificado com pequenas alterações na quantidade e a ausência do elemento Arno’S A5 em sua composição (Tabela I).
O pH do meio de cultivo foi neutralizado para 7.5 utilizando-se NaOH (5%) e H2SO4 (5%) para seu controle. Procurando determinar parâmetros de eficiência na concentração e tempo de cultivo, foram inoculados em três propostas, ou seja:
As inoculações e períodos utilizados para fins de observação foram:
1. Inoculação de 3.0 x 103 células/ml por um período de 8 dias
2. Inoculação de 1.6 x 103 células/ml por um período de 9 dias
 3. Inoculação de 3.9 x 103 células/ml por um período de 10 dias.
3. Inoculação de 3.9 x 103 células/ml por um período de 10 dias.
Para a realização das observações, o meio de cultivo e as algas foram inoculados em sacos de plástico de polietileno branco transparente de 50 x 20 cm com capacidade de 7 l. Foram utilizados 6 sacos plásticos com 3.5 litros do meio de Myer’s 4N modificado, mais as inoculações com densidade inicial das observações 1, 2 e 3 respectivamente.
O meio de cultura com as algas foram submetidas a aeração forçada contínua, e luz fluorescente continua com 1 200 lux de intensidade e temperatura constante de 27ºC conseguidos através de ar condicionado em uma câmara de cultivo utilizada para este fim.
As variáveis de qualidade de água foram analisadas no período inicial, quarto, oitavo, nono e decimo dia no Laboratório de Qualidade de Água da EPAGRI/Caçador SC. Sendo o pH através de um phmetro de marca Corning (PS-30), oxigênio dissolvido através de um oximetro de marca Orion/Jundilab, gás carbônico através do pH e alcalinidade, dureza, alcalinidade, amônia, nitríto através de colorimetria e finalmente a temperatura da água através de um termômetro eletrônico marca Thies Clima e a temperatura média do ambiente com aparelho de corda marca Wilh-Lambrech Gmbh Gottingen.
Ao término do período de cada observação foi realizada a avaliação da concentração populacional de algas (número de células/ml), utilizando-se hemocitômetro de Neubauer, sendo o resultado representado pelo valor médio de cinco contagens. Para conservação e verificar a viabilidade destas algas foi utilizado a geladeira e também o frezzer para posterior utilização. O tempo máximo de estocagem é de 6 meses, devendo dentro deste período ser usado ou multiplicado novamente para resguardar o material em condições ótimas.
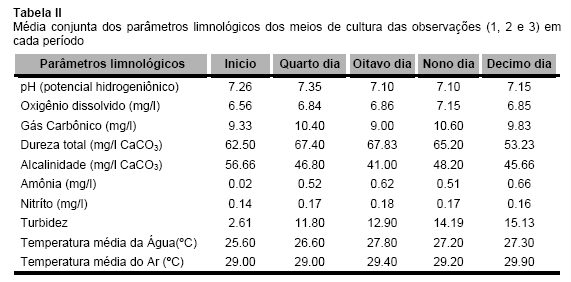
A qualidade da água das observações em relação as variáveis pH, O2D, CO2, dureza total, alcalinidade, amônia e nitrito estão na Tabela II.
A temperatura média interna dos cultivos foi de 27ºC, segundo Kerby e Stewart (12), muitas espécies de fitoplâncton, dentre elas Chlorella minutissima exigem temperaturas da água entre 20 a 30ºC para um rápido crescimento, portanto as temperaturas do presente trabalho estão dentro do recomendado, apesar que Coutteau (7) afirmar que algumas espécies de microalgas podem tolerar níveis de temperatura variando de 16 a 27ºC, sendo a temperatura ótima para cultivo destas variando entre 20 e 24ºC.
A intensidade luminosa constante incidente na superfície das bolsas plásticas, durante todo o período foram de 1.200 lux, bem abaixo do relatado por outros trabalhos (13), que foi em média 3 200 lux com fotoperíodo de 12 horas, mas a aeração constante e vigorosa, vinda do fundo das bolsas plásticas, ocasionava boa movimentação nas culturas, evitando sedimentação das células e proporcionando iguais oportunidades de exposição à luz.
As condições do meio de cultura estavam muito boas para o desenvolvimento da Chlorella minutissima conforme as observações. Os resultados do desenvolvimento das populações cultivadas atingiram o máximo de crescimento entre o oitavo e decimo dia de cultivo, tendo alcançado concentrações máximas de até 2.7 x 107 células/ml ficando a média de 1.5 x 107 células/ml, não observando diferenças marcantes pela concentração inicial das algas.
As concentrações celulares da alga obtidas no presente trabalho foram consideradas satisfatórias em função das densidades iniciais médias terem sido de 2.8 x 103 células/ml.
Realizando cultivo com Chlorella homophaera Tanji et al. (14) em laboratório (meio de cultura WC-N/5) verificaram concentração máxima de 3.06 x 106 células/ml, ao término de 14 dias. Também Portella et al. (13) conseguiu concentrações máximas de aproximadamente 5.0 x 106 células/ml ao término do sexto dia. Esses valores diferentes com certeza se devem as condições de cultivo também diferentes. Concentrações celulares semelhantes ao presente trabalho (1.4 x 107 células/ml) são relatadas por outros pesquisadores (14) com Chlorella minutissima, e (15) com concentração de 1.1 x 107 células/ml com Chlorella stigmatophora.
Com este resultado demonstramos o desenvolvimento de um método simples de produção de Chlorella minutissima em condições intensiva em ambiente protegido, possibilitando a obtenção de grande número de algas de boa qualidade em qualquer época do ano, independentemente das condições ambientais.
É possível a produção intensiva de Chlorella minutissima em sacos plásticos transparentes com meio de cultura de Myer’s 4N modificado.
A partir da adaptação e aplicação dos métodos de produção de Chlorella minutissima foi possível o estabelecimento de uma rotina de produção deste organismo, que esta sendo utilizado no Laboratório de Nutrição de Peixes de Clima Tropical/EPAGRI em Caçador SC.
Ao Departamento de Limnologia da Universidade Federal de Santa Catarina pelo pronto atendimento no envio das cepas de Chlorella minutissima no que foi possível a realização deste trabalho.
1. ROUD FE. Economic aspects. En: The biology of the algae. 2. Ed. London, Edward Arnold, cap. 12, 1973:216-230
2. MILSTEIN A, HEPHER B, TELTSCH B. Principal component analysis of interactions between fish species and the ecological conditions in fish ponds: II. Zooplankton. Aquaculture and Fisheries Management, 1985; 16:319-330
3. ITO T. On the culture of the mixohaline rotifer Brachiorus plicatilis O. F. Muller in the sea water. Report Fac. Fish Prefec. 1960 Univ. Mie.
4. LUBZENS E, SAGIE G, MINKOFF G, MERAGELMAM E, SCHNELLE, A. Rotifers (Brachiorus plicatilis) improve growth rate of carp (Cyprinus carpio) larvae. Bamidgeh, 1984; Nir-David, 32(2):41-46
5. LUBZENS E. Raising rotifers for use in aquaculture. Hydrobiologia, 1987; Washington, 147:245-255,
6. BENEMAMM JR. Microalgae aquaculture feeds. Journal of Applied Phycology, Belgium, 1992; 4:233-245
7. COUTTEAU P. Microalgae. En: LAVENS P, SORGELOOS P. (eds) Manual on the production and use of live food for aquaculture. FAO-Fisheries Techinical Paper. 1996. N. 361 Rome, FAO. 295 p.
8. ALBERTOSA M, RICARDO B, PREZEM A. Determinativo of. optimal conditions for growth of clam (Venerupis pullastra) seed. Aquaculture 1994; 126: 315-328.
9. FURUSHO K., HARA O, YOSHIO J. Mass prodution of the rotifer, Brachiorus plicatilis, by feeding Chlorella sp. And yeast using large-scale outdoor tanks. The Aquiculture, 1976; 24 (3):96-101,
10. SASSAKI I. Cultivo de zooplancton como alimento inicial na criação de animais aquáticos. Relatório do Projeto Pitú/PDP. Colatina, ES. 24p.
11. LOOSANOFF VL. Culturing phytoplankton on large scale. Ecology, 1951; 32(4): 748-750
12. KERBY NW, STEWART DP. The biotechnology of microalgae and cyanobacteria. En: ROGERS LJ, GALLON JR. (eds). Biochemistry of the Algae and Cyanobacteria. Proceedings of the Phytochemical Society of Europe-28.Oxford Scientifics Publications, 1988
13. PORTELLA MC, CESTAROLLI MA, VERANI JR, ROJAS NET. Produção de organismos planctônicos para alimentação inicial de larvas de peixes de água doce. B. Inst. Pesca, São Paulo,1997; 24(único):79-89
14. TANJI S, MISHIMA M, POZZI R. Cultivo de Chlorella ellipsoidea S-1 em sacos plásticos. B. Inst. Pesca, São Paulo, 10(único):9-16
15. MERAGELMAN E, LUBZENS E, MINKOFF G. A modular system for small scale production of the rotifer Brachionus plicatilis. Israel Journal of Zoology, Nir-David, 1997; 33:186-194.
Alvaro Graeff EPAGRI – agraeff[arroba]epagri.rct-sc.br
Empresa de Pesquisa Agropecuária e Extensão Rural de Santa Catarina SA, Estação Experimental de Caçador, Unidade Experimental de Piscicultura, Caçador, Santa Catarina (Brasil).
 Página anterior Página anterior |   Voltar ao início do trabalho Voltar ao início do trabalho | Página seguinte  |
|
|
|